El sistema inmunitario participa en las alteraciones cerebrales que causan alcoholismo
El alcohol aumenta su capacidad adictiva cambiando la geometría del espacio extracelular de la sustancia gris del cerebro. Así concluye una nueva investigación realizada en ratas y humanos que publica esta semana la revista Science Advances. El trabajo, coordinado por Santiago Canals, del Instituto de Neurociencias (IN-CSIC), y Wolfgang Sommer, del Instituto Central de Salud Mental de la Universidad de Heidelberg (Alemania), propone un mecanismo de adicción al alcohol desconocido hasta ahora. El alcohol activa las células inmunitarias, que cambian su forma y características bioquímicas. Esta activación habilita rutas de difusión de compuestos que, sin el tóxico, estarían limitadas Así, los expertos han comprobado que las responsables de dicho cambio son las células del sistema inmunitario que residen en el cerebro, denominadas microglía. El uso de esta sustancia tóxica activa estas células de defensa, que cambian su forma y características bioquímicas. Esta activación habilita rutas de difusión de compuestos que, en ausencia de alcohol, estarían limitadas. “El espacio extracelular está formado por los huecos y canales que dejan libres los cuerpos celulares y sus densas ramificaciones citoplasmáticas, como las dendritas y los axones de las neuronas y otras células gliales, y está ocupado por líquido y proteínas”, explica Canals. “En el líquido extracelular circulan sustancias fundamentales para muchos procesos fisiológicos”. “Al encoger sus numerosas prolongaciones, la microglía elimina barreras para la difusión, o lo que es lo mismo, habilita rutas que estaban bloqueadas. El siguiente paso es averiguar si este efecto es producido directamente por la acción del alcohol sobre la microglía, o lo hace de forma indirecta a través de intermediarios, como podrían ser el hígado o la microbiota intestinal”, añade. Daños en el cerebro tras dejar de beberEn un trabajo previo, publicado en abril de 2019 en JAMA Psychiatry, este mismo grupo demostró que el alcohol sigue dañando el cerebro incluso después de dejar de beber. El hallazgo reflejaba un aumento de la difusividad en el cerebro por efecto del tóxico, pero los investigadores no sabían aún el motivo. Este nuevo estudio, continuación del anterior, resuelve el misterio al demostrar que se debe a la activación de las células inmunitarias del cerebro y tendría un efecto importante sobre los neurotransmisores que se propagan en volumen, como la dopamina, fundamental para el funcionamiento del sistema de recompensa del cerebro. “La transmisión en volumen es una comunicación ‘punto a punto’ entre un elemento presináptico y otro postsináptico. En ella, el neurotransmisor se libera al espacio extracelular y difunde por él, como una hormona, afectando a más de un elemento postsináptico”, aclara Silvia de Santis, del IN-CSIC y primera firmante del artículo. “Si la difusión en la sustancia gris está aumentada, la transmisión por volumen también”. “Por una vía indirecta, como es cambiar la geometría del espacio extracelular, el alcohol facilita la adicción. Comprender y revertir estos cambios puede ayudar al desarrollo de tratamientos más eficaces”, afirman los autores El alcohol facilita la adicciónEste estudio demuestra que hay una mayor difusividad media en la materia gris cerebral de los seres humanos y ratas que beben habitualmente. Estas alteraciones aparecen poco después del inicio del consumo en los roedores, persisten en la abstinencia temprana tanto en ratas como en humanos, y se asocian con una fuerte disminución de las barreras del espacio extracelular, explicada por una reacción de la microglía a un agente agresor como el alcohol. “Por una vía indirecta, como es cambiar la geometría del espacio extracelular, el alcohol facilita la adicción. Este es un mecanismo totalmente nuevo. Al mismo tiempo, identificamos también un nuevo sistema de interacción inmunitaria-cerebral”, resalta Wolfgang Sommer. Para los autores, el aumento de la concentración y alcance espacial de neurotransmisores –como dopamina, glutamato o neuropéptidos– puede convertir las propiedades gratificantes débiles del alcohol en poderosos factores en la formación de hábitos de consumo, que eventualmente conduzcan a la adicción. “Comprender y revertir estos cambios puede ayudar al desarrollo de tratamientos más eficaces”, afirman. ****************************************************** Cómo regula la mitocondria la producción de energíaInvestigadores del Centro Nacional de Enfermedades Cardiovasculares (CNIC) han descubierto el mecanismo molecular por el que la mitocondria –la fuente energética de las células– regula su funcionamiento para adaptar de forma óptima la producción de energía a las necesidades del organismo. El hallazgo, publicado en Science Advances, ayuda a entender cómo se regula nuestro metabolismo. Dirigido por Jesús Vázquez y José Antonio Enríquez, con la participación de Jesús Francisco Rodríguez Huertas, del Centro de Investigación Biomédica (CIBM), el estudio muestra que la cadena de transporte de electrones de la mitocondria ajusta su eficiencia energética para adaptarse a las necesidades del organismo a través de la asociación regulada de sus estructuras macromoleculares. La proteína SCAF1 es un factor clave en la regulación del metabolismo energético, optimizando la eficiencia de la mitocondria ante altas demandas de energía Además, la proteína SCAF1, descubierta por este mismo equipo en 2016, es un factor clave en la regulación del metabolismo energético, optimizando la eficiencia de la mitocondria ante altas demandas de energía. Las mitocondrias, y dentro de ellas la cadena de transporte electrónico, se encargan de producir la energía que necesita la célula, ajustando su funcionamiento para satisfacer las necesidades metabólicas del organismo. Según explica Enríquez, “la cadena de transporte electrónico o CTE produce energía a partir de moléculas nutricionales, como la glucosa o los ácidos grasos. Además, desempeña un papel importante en la síntesis de moléculas necesarias para mantener la salud de las células y del organismo”. La cadena respiratoria mitocondrial está formada por cuatro grandes complejos multiproteicos –CI, CII, CIII y CIV–, que tienen la capacidad de reorganizarse estructuralmente de diferentes maneras para realizar diferentes funciones y adaptarse a las condiciones del entorno. Papel en la eficiencia energéticaEn 2016, este grupo descubrió que la proteína SCAF1 forma un puente entre los complejos CIII y CIV, actuando como un ‘interruptor molecular’ que regula el ensamblaje de dichos complejos dando lugar a la formación de superestructuras dentro de la CTE. Sin embargo, “desconocíamos si estas estructuras reguladas por SCAF1 desempeñan algún papel en la eficiencia energética de la mitocondria y qué implicaciones fisiológicas tienen sobre el organismo”, indica Vázquez. Tras ser sometidos a un intenso esfuerzo, los ratones que no expresan SCAF1 tienen un rendimiento físico un 30 % más bajo que los ratones normales En el nuevo trabajo se ha demostrado que la formación de estructuras específicas de la cadena de transporte electrónico reguladas por SCAF1 no solo afecta a la eficiencia de producción de energía en la mitocondria, sino también a la capacidad del organismo para responder ante situaciones de estrés fisiológico. “Hemos utilizado modelos de ratones y cultivos de células de ratón en los que se había eliminado el gen de la proteína SCAF1 mediante ingeniería genética –y que, por lo tanto, no podían producirla– para estudiar de qué manera les afectaba la eliminación de esta proteína”, explica Enrique Calvo, uno de los autores principales junto a Sara Cogliati, Pablo Hernansanz-Agustín y Marta Loureiro-López. “Demostramos que, en ausencia de SCAF1, los complejos de la CTE se reorganizan a nivel molecular de forma subóptima y, también, que son menos eficientes a la hora de producir energía”, señala por su parte Hernansanz-Agustín. Además, el estudio ha descubierto que los ratones que no expresan SCAF1, tras ser sometidos a un intenso esfuerzo, “tienen un rendimiento físico un 30 % más bajo que los ratones normales”, revela Cogliati.
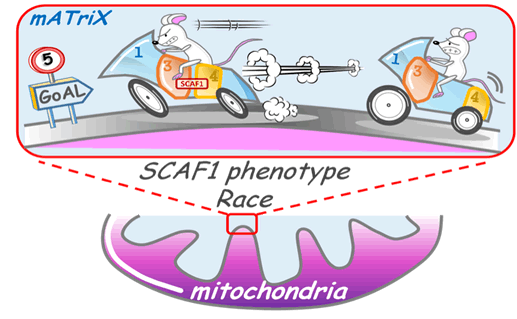
Asociación de los complejos respiratorios I, III y IV asociados para formar el supercomplejo N-respirasoma. La presencia o ausencia de la proteína SCAF1 determina la eficiencia en la utilización de la fuente de energía (alimentos) para convertirlo en trabajo productivo al mantener los complejos III y IV físicamente conectados dentro del N-respirasoma. SCAF1 funcionaria como las marchas de una moto permitiendo regular eficientemente el rendimiento. / CNIC SCAF1, un factor reguladorEstos resultados explican molecularmente los resultados observados en otro trabajo, publicado recientemente en EMBO Reports, y realizado en colaboración con el grupo de Nadia Mercader, de la Universidad de Berna (Suiza), en el que los investigadores vieron que la ablación de la proteína SCAF1 en el pez cebra perjudica su metabolismo, crecimiento y fertilidad. Esta adaptación metabólica explica la capacidad que tiene la mitocondria de adaptarse a situaciones de estrés, como las producidas por un ejercicio físico intenso Según los investigadores, estos resultados demuestran que la asociación física entre los complejos CIII y CIV, mediada por SCAF1, es determinante para que la mitocondria produzca energía de forma óptima. “SCAF1 actúa como un factor regulador que permite a la mitocondria adaptarse a la fuente nutricional disponible de azúcares, grasas o proteínas. Esta adaptación metabólica explica, además, la capacidad que tiene la mitocondria de adaptarse a situaciones de estrés como las producidas por un ejercicio físico intenso”, concluye Marta Loureiro-López.
|
||||||||||||||||||||||||||||||